Инструкция к вакцине Arepanrix™ H1N1 с адъювантом AS03 против пандемического гриппа
Информация о продукте: Вакцина Arepanrix™ H1N1 с адъювантом AS03 против пандемического гриппа, предназначенная для использования в Канаде.
Эта вакцина вместе с российской "МоноГриппол Нео" проходит процедуру регистрации для массового использования в Украине.
Комментарии переводчика и ОО "Лига защиты гражданских прав" по этому поводу см. ниже.
Министерство здравоохранения Канады разрешило продажи вакцины Arepanrix™ H1N1, основываясь на данных ограниченных клинических испытаний на людях в соответствии с положениями Временного Порядка, обнародованного 13 октября 2009. Разрешение базируется на изучении Минздравом Канады имеющейся информации о ее качестве, безопасности и иммуногенности. Учитывая текущую угрозу пандемии и ее риск для здоровья людей, Минздрав Канады считает соотношение преимуществ и риска от вакцины Arepanrix™ H1N1 приемлемым для активной иммунизации населения против штамма гриппа H1N1 2009 в условиях официально объявленной пандемической ситуации.
В рамках разрешения на продажу Arepanrix™ H1N1 Минздрав Канады требует от инициатора предоставления постмаркетинговых обязательств. Выполнение этих обязательств и обновление информации о качестве, неклинических и клинических данных будет постоянно мониториться Минздравом Канады и Агентством Общественного Здравоохранения Канады.
Эта информация была подготовлена компанией GlaxoSmithKline Inc. для специалистов здравоохранения, потребителей и других заинтересованных сторон.
Редакция 1, утверждена 21 октября 2009
Эта брошюра будет соответственно обновляться.
Обратитесь на сайт Министерства здравоохранения Канады относительно последней актуальной информации для данного продукта.
Рекомендации Агентства Общественного Здравоохранения Канады также должны приниматься во внимание.
Оглавление
1.0 Форма выпуска
2.0 Качественный и количественный состав
- Способ применения и дозировка
- Противопоказания
- Меры безопасности
- Взаимодействие
- Влияние на способность управлять автомобилем и механизмами
- Побочные реакции
- Клинические испытания
- Передозировка
4.0 Фармакологические свойства
5.0 Фармацевтические особенности
- Перечень вспомогательных веществ
- Несовместимость
- Срок годности
- Особые меры предосторожности для хранения
- Характер и содержание контейнеров
- Инструкции по использованию / транспортировки
- Информация для потребителя
1.0 Форма выпуска
Arepanrix™ H1N1 (вакцина против пандемического гриппа H1N1 с адъювантом AS03) является двухкомпонентной вакциной, состоящий из имунизующего антигена H1N1 (в виде суспензии), и адъюванта AS03 (в виде водо-масляной эмульсии).
Антиген H1N1 - это стерильная суспензия, бесцветная или легкого беловатого оттенка, может иметь небольшой осадок, расфасованная во флаконы 10 мл. Антиген изготовлен из вируса, выращенного в аллантоидной протоке эмбрионов куриных яиц. Вирус деактивирован воздействием ультрафиолета, потом формальдегидом, с последующей очисткой центрифугированием и расщеплением дезоксихолатом натрия.
Адъювантная система AS03 является стерильной гомогенизированной беловатой эмульсией, состоящей из DL-?-токоферола, сквалена и полисорбата-80 в 3 мл флаконе.
Непосредственно перед применением все содержимое флакона AS03 нужно добавить во флакон с антигеном (пропорция 1:1). Полученной в результате готовой эмульсии препарата достаточно для 10 доз.
2.0 Качественный и количественный состав
После соединения и смешивания двух компонентов 0,5 мл полученной эмульсии набирают в шприц для внутримышечних инъекций. Окончательный состав компонентов вакцины в дозе 0,5 мл таков:
Антиген:
Расщепленный вирус гриппа, инактивированный, содержащий антиген * эквивалентный штамму A/California/7/2009 (H1N1) v (X-179A) - 3,75 мкг HA ** на дозу 0,5 мл:
* Полученные из вируса, выращенного на куриных яйцах
** HA = гемагглютинин (haemagglutinin)
Содержание консерванта 5 мкг тимеросала USP на дозу 0,5 мл или 2,5 мкг органической ртути (Hg) на дозу 0,5 мл.
Адъювант:
DL-?-токоферол - 11,86 мг на дозу 0.5 мл,
Сквален - 10,69 мг на дозу 0.5 мл,
Полисорбат 80 - 4,86 мг на дозу 0.5 мл.
После смешивания содержимого флаконов с суспензией и эмульсией будет получено многодозовую вакцину. Количество доз во флаконе см. в разделе Форма и состав упаковки.
Для получения полного списка вспомогательных веществ, см. Список ингредиентов в разделе 5.0.
3.0 Клинические особенности
Вакцина Arepanrix™ H1N1 предназначена для активной иммунизации против штамма гриппа H1N1 в условиях официально объявленной пандемической ситуации.
(см. раздел 2.0 Качественный и количественный состав).
ПРИМЕНЕНИЕ
На данный момент опыт клинического применения Arepanrix™ H1N1 является ограниченным, также имеется ограниченный опыт клинического применения экспериментальной формулы другой вакцины с адъювантом AS03, содержащей такое же или немного большее количество антигена, полученного из штамма A/California/7/2009 (H1N1 ) (см. раздел Фармакодинамика), на здоровых взрослых в возрасте 18-60 лет, и еще нет опыта клинического применения для старшей возрастной группы, детей и подростков. Принимая решение об использовании Arepanrix™ H1N1 для каждой из указанных ниже возрастных групп, следует учитывать имеющийся массив клинических данных, доступных для версии вакцины с антигеном H5N1, и характеристики заболевания текущей пандемии гриппа.
Рекомендации о дозировке базируются на:
- доступных данных о безопасности и иммуногенности введения вакцины с адъювантом AS03, содержащей 3,75 мкг НА, полученного из вируса A/Indonesia/5/2005 (H5N1) (Arepanrix™ H5N1), на 0 и 21 день у взрослых, включая пожилых людей;
- доступных данных о безопасности и иммуногенности введения взрослой и половины взрослой дозы детям от 3 до 9 лет другой вакцины с адъювантом AS03, содержащей 3,75 мкг HA, полученного из вируса A/Vietnam/1194/2004 (H5N1), на 0 и 21 день;
- ограниченных данных 2-х исследований иммуногенности, полученных через три недели после введения одной дозы экспериментального состава другой вакцины H1N1 с адъювантом AS03, содержащей 5,25 мкг или 3,75 ?g HA, полученного из вируса A/California/7 / 2009 (H1N1) (Pandemrix™), здоровым взрослым в возрасте 18-60 лет. См. раздел Фармакодинамика.
Взрослые в возрасте 18-60 лет:
Одна доза 0,5 мл в выбранный день.
О необходимости второй дозы пока неизвестно. Однако, предварительные данные об иммуногенности, полученные через три недели после введения экспериментального состава другой вакцины H1N1 с адъювантом AS03, содержащей 5,25 мкг или 3,75 мкг HA, полученного из вируса A/California/7/2009 (H1N1) (Pandemrix™), ограниченному числу здоровых взрослых в возрасте 18-60 лет, позволяют предположить, что одной дозы может быть достаточно для этой возрастной группы. См. раздел Фармакодинамика.
Если есть необходимость во второй дозе, ее следует вводить с интервалом не менее 3 недель.
Пожилые люди (> 60 лет):
Нет клинических данных о применении Arepanrix™ H1N1 для этой возрастной группы. Можно рассматривать применение 1 дозы 0,5 мл в выбранный день.
О необходимости второй дозы вакцины неизвестно. Если есть необходимость во второй дозе, ее следует вводить с интервалом не менее 3 недель. См. раздел Фармакодинаміка.
Дети и подростки в возрасте 10-17 лет:
Нет клинических данных о применении любых вакцин против гриппа с AS03 для этой возрастной группы. Можно рассматривать применение согласно дозировке для взрослых.
Дети 3-9 лет:
На основе ограниченных клинических данных о применении вакцины H5N1 с адъювантом AS03, содержащей 3,75 мкг HA, полученного из вируса A/Vietnam/1194/2004, для этой возрастной группы - можно рассматривать достаточной дозировку 0,25 мл вакцины (половина взрослой дозы) в выбранный день и вторую дозу с интервалом не менее 3 недель. См. раздел Фармакодинамика.
Дети 6-35 месяцев:
Нет клинических данных о применении вакцин против гриппа с AS03 для этой возрастной группы. Можно рассматривать применение согласно дозировке для детей 3-9 лет.
Дети до 6 месяцев:
Для этой возрастной группы вакцинация на данный момент не рекомендуется.
Для получения дополнительной информации см. раздел Фармакодинамика.
Способ применения:
Иммунизацию следует производить внутримышечной инъекцией, желательно в дельтовидную мышцу или в переднюю боковую часть бедра (в зависимости от мышечной массы).
Противопоказания
История анафилактических (т.е. угрожающих жизни) реакций на любой из компонентов или остаточных веществ этой вакцины.
См. также раздел Меры безопасности.
Меры безопасности
С осторожностью следует вводить вакцину людям с известной гиперчувствительностью (кроме анафилактических реакций) к активной субстанции, любым вспомогательным веществам или примесям.
Как и со всеми инъекционными вакцинами, нужен соответствующий медицинский надзор и наличие соответствующих средств на случай редких анафилактических реакций после введения вакцины.
Если пандемическая ситуация позволяет, иммунизацию лиц с острыми инфекционными заболеваниями или высокой температурой следует отложить.
Ни при каких условиях нельзя вводить Arepanrix™ H1N1 внутривенно или подкожно.
Образование антител у пациентов с эндогенными или ятрогенными иммуносупрессиями может быть недостаточным.
Защитный иммунный ответ может создаваться не всеми вакцинами (см. раздел Фармакокинетика).
Дети:
Есть очень ограниченный опыт использования вакцины H5N1 с адъювантом AS03 для детей от 3 до 9 лет, и совсем нет опыта для детей до 3 лет и подростков 10-17 лет. См. разделы Дозировка и применение, Побочные реакции и Фармакодинамика.
Беременность и лактация
Нет данных о применении вакцины Arepanrix™ H1N1 или ее прототипа (вакцины H5N1) с адъювантом AS03 для беременных женщин. Данные о вакцинации беременных женщин трехвалентными вакцинами против сезонного гриппа не указывают на то, что такие вакцины вызывают вредные последствия для эмбриона или матери.
Следует принимать во внимание все рекомендации Агентства Охраны Общественного Здоровья Канады.
Исследования на животных не показали вредного влияния по отношению к фертильности, беременности, развитию эмбриона / плода, родам или постнатальному развитию (см. также раздел Неклиническая информация).
Нет данных об использовании вакцины для кормящих грудью.
Взаимодействие
Нет данных об одновременном введении Arepanrix™ H1N1 с другими вакцинами, включая трехвалентную вакцину против сезонного гриппа. Эти данные сейчас собираются, и документ будет дополнен, как только они будут в наличии. Однако, если предусмотрено одновременное введение с другой вакциной, их следует вводить в разные конечности. Есть сообщения, что побочные реакции в таких случаях могут быть более сильными.
Иммунный ответ может быть ослабленным, если пациент принимает иммуносупрессивное лечение.
После вакцинации против гриппа могут быть получены ложноположительные серологические результаты на антитела к ВИЧ-1, гепатит С и особенно HTLV-1 по методу ELISA. Эти временные ложноположительные реакции могут быть вызваны кросс-реакцией IgM, спровоцированной вакциной. По этой причине достоверная диагностика ВИЧ-1, гепатита C и HTLV-1 требует положительного результата подтверждающего теста для конкретного вируса (например Western Blot или immunoblot).
Влияние на способность управлять автомобилем и механизмами
Не проводилось исследований влияния на возможность управления транспортными средствами и механизмами.
Побочные реакции
Исследования H1N1:
Предварительные данные о реактогенности (ожидаемые местные и общие побочные реакции, зарегистрированные в течение 7 дней после вакцинации) получены из 2-х исследований безопасности, проведенных для другой вакцины с адъювантом AS03, содержащей HA вируса типа A/California/7/2009 (H1N1) v (Pandemrix™), на здоровых испытуемых в возрасте 18-60 лет. В другом исследовании вакцина содержит большее количество антигена (5,25 мкг HA). В обоих исследованиях группа испытуемых получала вакцину без адъюванта AS03. О наличии возможных местных и общих симптомов чаще сообщалось в группе H1N1 + AS03, чем в группе H1N1. Среди побочных реакций (АЕ), о которых сообщалось чаще всего, - боль в месте введения. Частота симптомов, которые "характеризовались" уровнем 3, не превышала 1,6%.
Таблица H1N1-021 (0 - 6 день, ожидаемые побочные реакции после 1 дозы вакцины H1N1, содержащий 5,25 мкг HA + AS03 [Pandemrix™] в сравнении с одной дозой вакцины H1N1, содержащей 21 мкг HA без адъюванта) - побочные действия с причинно-следственной связью.
|
Побочные реакции |
H1N1/AS03 |
H1N1 |
|
Боль |
88,9% |
59,1% |
|
Покраснение |
31,7% |
4,5% |
|
Отек |
30,2% |
11,5% |
|
Усталость |
15,9% |
10,6% |
|
Головная боль |
14,3% |
7,6% |
|
Артралгии |
14,3% |
3,0% |
|
Миалгии |
15,9% |
4,5% |
|
Озноб |
3,2% |
4,5% |
|
Потоотделение |
6,3% |
4,5% |
|
Лихорадка |
0,0% |
0,0% |
Таблица H1N1-007 (0 - 6 день, ожидаемые побочные реакции после 1 дозы вакцины H1N1, содержащий 3,75 мкг HA + AS03 [Pandemrix™] в сравнении с одной дозой вакцины H1N1, содержащей 15 мкг HA без адъювант) - побочные действия с причинной связью.
|
Побочные реакции |
H1N1/AS03 |
H1N1 |
|
Боль |
90,3% |
37,1% |
|
Покраснение |
1,6% |
0,0% |
|
Отек |
6,5% |
0,0% |
|
Усталость |
32,3% |
25,8% |
|
Головная боль |
14,3% |
7,6% |
|
Артралгии |
11,3% |
4,8% |
|
Миалгии |
33,9% |
8,1% |
|
Озноб |
8,1% |
3,2% |
|
Потоотделение |
9,7% |
8,1% |
|
Лихорадка |
0,0% |
0,0% |
Всего было сообщено о 4 случаях серьезных побочных реакций (SAE) при исследованиях H1N1. Три из них исследователи не связывают с исспытуемой вакциной. Один случай гиперчувствительности связывают с вакциной.
Исследования H5N1:
Клинические испытания
Побочные действия, проявленные во время клинических испытаний экспериментальной вакцины, приведены ниже:
Взрослые:
Во время клинических испытаний был оценен процент побочных реакций среди примерно 3500 испытуемых, начиная с 18-летнего возраста, получивших противогриппозную вакцину, содержащую штамм A/Indonesia/05/2005 (Arepanrix™ H5N1) с менее 3,75 мкг HA/AS03.
Реактогеннисть вакцинации получена по результатам сбора побочных реакций с помощью стандартизированных форм в течении 7 дней, следующих после вакцинации Arepanrix™ H5N1 или плацебо (т.е. День 0 - День 6). Средняя частота полученных местных и общих побочных реакций, сообщенных в течение 7 дней после каждой дозы вакцины, приведена ниже:
Процент доз, после введения которых были сообщения о местных или общих реакциях в течение 7 дней после любой вакцинации Arepanrix™ H5N1 (Общий вакцинированный контингент *)
|
Местные |
Arepanrix™ H5N1 |
Плацебо |
|
N = 6647 доз |
N = 2209 доз | |
|
Боль |
73,1 |
12,0 |
|
Отек |
6,7 |
0,4 |
|
Покраснение |
5,25 |
0,4 |
|
Общие |
N = 6639 доз |
N = 2210 доз |
|
Боль в мышцах |
33,3 |
11,8 |
|
Головная боль |
23,4 |
17,6 |
|
Усталость |
23,3 |
14,1 |
|
Боль в суставах |
16,4 |
7,4 |
|
Озноб |
9,8 |
6,0 |
|
Потоотделение |
6,3 |
4,4 |
|
Лихорадка, ? 38,0 ° C |
2,4 |
1,9 |
* Общий вакцинированных контингент = все субъекты, получившие хотя бы одну дозу вакцины, по которым имеются данные о ее безопасности.
Из ожидаемых местных реакций чаще всего сообщается о боли в месте инъекции в обеих группах: Arepanrix™ H5N1 и плацебо. В группе Arepanrix™ H5N1 об этой реакцию сообщалось в 6 раз чаще (73% доз). Несмотря на высокий процент сообщений о боли в месте инъекции, процент реакций с сильной болью низок, о нем сообщают после 2,7% доз Arepanrix™ H5N1 и 0,4% доз плацебо... В общем, тяжелые ожидаемые и неожиданные побочные реакции любого типа возникали в течение 7 дней после введения от 6,4 до 7,0% доз Arepanrix™ H5N1 и 3,6% доз плацебо. Самыми распространенными тяжелыми побочными реакциями была локальная боль в месте инъекции, все тяжелые общие ожидаемые реакции возникали после менее чем 2% доз.
Прочие/дополнительные сообщенные побочные реакции, перечисленные согласно частотной классификации:
- очень частые (более 1 / 10),
- частые (от 1 / 100 до 1 / 10),
- нечастые (от 1 / 1000 до 1 / 100),
- редкие (от 1 / 10000 до 1 / 1000),
- очень редкие (реже 1 / 10000),
- неизвестные (невозможно определить из имеющихся данных).
Расстройства кровеносной и лимфатической систем
Частые: лимфаденопатия
Психические расстройства
Нечасто: бессонница
Расстройства нервной системы
Нечасто: головокружение, парестезия
Расстройства со стороны органа слуха и равновесия
Нечасто: головокружение
Расстройства со стороны органов дыхания, грудной клетки и средостения
Нечасто: одышка
Желудочно-кишечные расстройства
Частые: тошнота, диарея
Редкие: боли в животе, рвота, расстройство пищеварения, дискомфорт в желудке
Со стороны кожи и подкожных тканей
Частые: зуд
Нечасто: сыпь
Расстройства мышечно-скелетных и соединительных тканей
Нечастые: боль в спине, костно-мышечная скованность, боль в шее, мышечные спазмы, боли в конечностях
Общие нарушения и состояние места инъекции
Частые: реакции в месте инъекции (гематомы, зуд, горячесть)
Нечасто: слабость, боль в груди, плохое самочувствие
Серьезные побочные реакции у взрослых
Общий отчет о безопасности был разработан на основе данных первых 9873 взрослых, получивших инъекции Arepanrix™ H5N1 или очень подобного препарата Pandemrix™ H5N1 с антигеном гриппа, изготовленного в Германии с добавлением адъюванта AS03. В эти исследования были привлечены взрослые в возрасте от 18 лет и старше с предыдущими хроническими заболеваниями. В первоначальном анализе, в ходе которого сравнивалось 6-месячное наблюдение за безопасностью после введения 7224 реципиентам препарата Arepanrix™ H5N1 или Pandemrix™ H5N1 и такое же наблюдение за 2408 реципиентами вакцины от сезонного гриппа или плацебо, серьезные побочные реакции возникли у 1,6% реципиентов Arepanrix™ H5N1 или Pandemrix™ H5N1 (95% доверительный интервал 1,3 - 1,9%) против 1,3% реципиентов вакцины от сезонного гриппа (95% доверительный интервал 0,7 - 2,0%) и 1,8% у реципиентов плацебо (95% доверительный интервал 1,1 - 2,8%). Исследователи не связывают ни одну из серьезных реакций с исследуемым препаратом. Среди реципиентов Arepanrix™ H5N1 или Pandemix™ H5N1 пятеро (<0,1%) получили фатальные серьезные побочные реакции, в том числе два случая карциномы яичников, злокачественное метастазное образования неопределенного типа, инфаркт миокарда, обострение сахарного диабета и цирроз печени. Среди реципиентов плацебо трое (0,1%) получили фатальные серьезные побочные реакции, один случай опухоли мозга, один случай кардиомегалии после хронического обструктивного легочного заболевания, и один случай двусторонней пневмонии. За период 6 месяцев наблюдения за общей группой 9873 реципиентов Arepanrix™ или Pandemrix™ H5N1 7 (<0,1%) сообщили о побочной реакции из перечня тех, которые заслуживают тщательного исследования, определенного EMEA. Четверо человек сообщили о параличе лицевого нерва (паралич Белла) в период от нескольких часов до 135 дней после введения вакцины, все проявления исчезли полностью и без вмешательства. 45-летний мужчина имел анафилактическую аллергическую реакцию на пищу через 6 дней после первого введения вакцины H5N / AS03, а 25-летняя белая женщина имела один судорожный припадок через 35 дней после введения второй дозы. Исследователи не связывают ни одной из этих реакций из перечня заслуживающих тщательного исследования, с введенным препаратом. Одна 48-летняя женщина имела приступ "неврита" почти сразу после инъекции. Симптомы были полностью локализованы в той руке, в которую делали инъекцию, и исчезли без вмешательства. Одиннадцать из 9873 (0,1%) реципиентов Arepanrix™ или Pandemrix™ H5N1 сообщили о возможных иммуно-обусловленных заболеваниях. Диагнозы включали два случая псориаза, четыре случая ревматической полимиалгии (все у женщин от 59 до 84 лет, у трех из них симптомы наблюдались и до вакцинации) и по одному случаю диффузно-токсического зоба, увеита, склеродермии, изолированного паралича IV нерва (?) и узловой эритемы. Ни один из этих случаев исследователи не отнесли к серьезным побочным реакциям или реакциям, связанным с исследуемой вакциной.
Дети в возрасте 3-9 лет:
Во время клинических исследований оценена реактогенность у детей возрастных групп от 3 до 5 и от 6 до 9 лет, которые получали полную или половинную дозу вакцины с адъювантом AS03, содержавшая 3,75 мкг HA, полученного из вируса A/Vietnam/1194 / 2004 (H5N1).
Частота реакций на одну дозу у детей, получавших полную дозу вакцины с адъювантом AS03, содержавшаую 3,75 мкг HA, полученного из вируса A/Vietnam/1194/2004 (H5N1), была выше, чем у групп детей, получавших половинную дозу, кроме реакции покраснения в группе 6-9 лет. Частота специфических ожидаемых побочных реакций через 7 дней после каждой дозы представлена в таблице. Реакции уровня 3 (тяжелые) всех типов, ожидаемые и неожиданные, на протяжении 7 дней наблюдались после 9,3% доз Arepanrix™ H5N1 и после 2,8% контрольных доз вакцины Fluarix™.
Реактогеннисть у детей возрастных групп от 3 до 5 и от 6 до 9 лет (полная или половинная доза вакцины с адъювантом AS03, содержавшая 3,75 мкг HA, полученного из A/Vietnam/1194/2004 (H5N1) по сравнению с Fluarix™) - реакции с причинной связью.
|
Побочные реакции |
3-5 лет |
6-9 лет | ||||||
|
Половинная доза |
Fluarix |
Полная доза |
Fluarix |
Половинная доза |
Fluarix |
Полная доза |
Fluarix | |
|
Уплотнение |
9,9% |
2,9% |
18,6% |
0% |
12,0% |
22,2% |
12,2% |
2,8% |
|
Боль |
48,5% |
28,6% |
62,9% |
23,5% |
68,0% |
58,3% |
73,5% |
61,1% |
|
Покраснение |
10,9% |
5,7% |
19,6% |
8,8% |
13,0% |
16,7% |
6,1% |
2,8% |
|
Отек |
11,9% |
2,9% |
24,7% |
5,9% |
14,0% |
19,4% |
20,4% |
8,3% |
|
Лихорадка (> 38 ° C) |
2,0% |
0% |
6,2% |
0% |
2,0% |
2,8% |
10,2% |
0% |
|
Лихорадка (> 39 ° C) на дозу, частота |
2,0% |
0% |
5,2% |
0% |
0% |
2,8% |
7,1% |
0% |
|
Лихорадка (> 39 ° C) на реципиента, частота |
3,9% |
0% |
10,2% |
0% |
0% |
5,6% |
14,3% |
0% |
|
Сонливость |
7,9% |
2,9% |
13,4% |
2,9% |
NA |
NA |
NA |
NA |
|
Раздражительность |
7,9% |
2,9% |
18,6% |
0% |
NA |
NA |
NA |
NA |
|
Потеря аппетита |
6,9% |
2,9% |
16,5% |
2,9% |
NA |
NA |
NA |
NA |
|
Озноб |
1,0% |
0% |
12,4% |
2,9% |
4,0% |
5,6% |
14,3% |
11,1% |
NA = Нет данных
Серьезные реакции (SAE) у детей
В анализируемой клинической базе данных, которая охватывает 180-дневное наблюдение, среди детей в возрасте 3-9 лет, получивших половинную дозу вакцины A/Vietnam/1194/04/AS03, серьезных реакций не было зафиксировано. Среди детей, получивших полную дозу вакцины, один 5-летний мальчик госпитализирован с гастроэнтеритом через 19 дней после второй дозы, и 4-летняя девочка получила травматическое повреждение мозга через 54 дня после второй дозы. Ни один из этих случаев не связывают с вакцинацией, оба ребенка выздоровели. Одна 3-х летняя девочка, которая участвовала в испытании вакцины H5N1/AS03, содержавшей другой процент адъюванта, чем Arepanrix™ H1N1, получила диагноз аутоиммунного гепатита примерно через 1 год после введения одной дозы вакцины. Впоследствии было обнаружено, что у ребенка присутствовали существенные нарушения сывороточной трансаминазы (serum transaminases) еще до введения какой-либо вакцины. Одна 5-летняя девочка получила диагноз передний увеит через 8 дней после второй полной дозы Pandemrix™ H5N1. Реакцию рассматривают как возможно связанную с вакциной, однако также и как возникшую в условиях имеющегося набора инфекционных симптомов тонзиллита и гингвостоматита.
Пост-маркетинговые наблюдения
Во время постмаркетинговых наблюдения за применением сезонной трехвалентной вакцины (без AS03) сообщено о таких дополнительных побочных реакциях:
Расстройства кровеносной и лимфатической систем
Транзитная тромбоцитопения (Transient thrombocytopenia).
Расстройства иммунной системы
Аллергические реакции, которые в отдельных случаях приводили к шоку.
Расстройства нервной системы
Невралгия, судороги.
Неврологические расстройства, в частности энцефаломиелит, невриты и синдром Гийена-Барре.
Сосудистые расстройства
Васкулиты с преходящим поражением почек.
Со стороны кожи и подкожных тканей
Генерализованные кожные реакции, включая крапивницу
Передозировка
Недостаточно данных
4.0 Фармакологические свойства
Фармакодинамика
Фармакологическая группа: Вакцины от гриппа, ATC код J07BB02.
Исследования H1N1:
Минздрав Канады регулярно будет собирать новую информацию и обновлять этот раздел. О пандемическом штамме H1N1 пока известно следующее.
Иммунный ответ на экспериментальную формулу другой вакцины с адъювантом AS03, содержащую 5,25 мкг HA, полученного из A/California/7/2009 (H1N1) (Pandemrix™) у взрослых 18-60 лет
В клинических исследованиях, которые оценивали иммуногенность другой вакцины с адъювантом AS03, содержащей 5,25 мкг HA, полученного из v-образного антигена A/California/7/2009 (H1N1), у здоровых лиц в возрасте 18-60 лет образование антител anti-HA после 1 дозы распределилось следующим образом:
|
anti-HA антитела |
Иммунный ответ на v-антиген A/California/7/2009 (H1N1) 21 день после первой дозы | |
|
Вакцина H1N1 без адъюванта |
Вакцина H1N1 с адъювантом AS03 | |
|
Уровень серозащиты 1 |
97,0% |
98,4% |
|
Уровень сероконверсии 2 |
95,5% |
98,4% |
|
Фактор сероконверсии 3 |
41,4 |
41,4 |
1 Уровень серозащиты: пропорция лиц с титром угнетения гемагглютинина (HI) ? 1:40;
2 Уровень сероконверсии: пропорция лиц, которые были серонегативными до и имеют защитный титр ? 1:40 после вакцинации, или же были серопозитивными до вакцинации и получили 4-кратный рост титра;
3 Фактор сероконверсии: соотношение средне-геометрического титра (GMT) после вакцинации и до нее.
Иммунный ответ на экспериментальную формулу другой вакцины с адъювантом AS03, содержащей 3,75 мкг HA, полученного из A/California/7/2009 (H1N1) (Pandemrix™) у взрослых 18-60 лет
В клинических исследованиях, которые оценивали иммуногенность другой вакцины с адъювантом AS03, содержащей 3,75 мкг HA, полученного из v-образного антигена A/California/7/2009 (H1N1), у здоровых лиц в возрасте 18-60 лет образование антител anti-HA после 1 дозы распределилось следующим образом:
|
anti-HA антитела | Иммунный ответ на v-антиген A/California/7/2009 (H1N1) через 21 день после первой дозы | |
|
Вакцина H1N1 без адъюванта |
Вакцина H1N1 с адъювантом AS03 | |
|
Уровень серозащиты 1 |
93,9% |
100% |
|
Уровень сероконверсии 2 |
84,8% |
96,7% |
|
Фактор сероконверсии 3 |
31,0 |
43,3 |
1 Уровень серозащиты: пропорция лиц с титром угнетения гемагглютинина (HI) ? 1:40;
2 Уровень сероконверсии: пропорция лиц, которые были серонегативными до и имеют защитный титр ? 1:40 после вакцинации, или же были серопозитивными до вакцинации и получили 4-кратный рост титра;
3 Фактор сероконверсии: соотношение средне-геометрического титра (GMT) после вакцинации и до нее.
Исследования H5N1:
Предварительные данные, полученные для пандемический вакцины H1N1, дают основание предполагать, что иммуногенность вакцин H1N1 существенно отличается от иммуногенности вакцин H5N1. Этот раздел описывает клинические данные, полученные для экспериментальных вакцин, собранные во время клинических испытаний H5N1, другого штамма с пандемическим потенциалом.
Иммунный ответ на A/Indonesia/5/2005 (H5N1) у взрослых (от 18 лет):
Во время клинических испытаний была оценена иммуногенность вакцины с адъювантом AS03, содержащей 3,75 мкг HA, полученного из A/Indonesia/5/2005, у лиц старше 18 лет согласно графику 0, 21 день.
В следующем исследовании образование антител антигемаглютинина (anti-HA) на 21 день и через 6 месяцев после введения 2-й дозы было следующим:
|
anti-HA антитела | Иммунный ответ на A/Indonesia/5/2005 | |||
|
18-60 лет |
> 60 років | |||
|
День 42 |
День 180 |
День 42 |
День 180 | |
|
Уровень серозащиты 1 |
91% |
62% |
76,8% |
63,5% |
|
Уровень сероконверсии 2 |
91% |
62% |
76,4% |
62,5% |
|
Фактор сероконверсии 3 |
51,4 |
7,4 |
17,2 |
7,8 |
1 Уровень серозащиты: пропорция лиц с титром угнетения гемагглютинина (HI) ? 1:40;
2 Уровень сероконверсии: пропорция лиц, которые были серонегативными до и имеют защитный титр ? 1:40 после вакцинации, или же были серопозитивными до вакцинации и получили 4-кратный рост титра;
3 Фактор сероконверсии: соотношение средне-геометрического титра (GMT) после вакцинации и до нее.
Через 21 день после второй дозы четырехкратный рост нейтрализующих антител к A/Indonesia/5/2005 был достигнут у 94,4% лиц в возрасте 18-60 лет и 80,4% лиц старше 60 лет.
Иммунный ответ на A/Vietnam/1194/2004 (H5N1) у детей (3 - 9 лет)
В ходе клинического исследования была оценена иммуногенность и безопасность у детей возрастных групп от 3 до 9 лет. В этом исследовании 49 детей в возрасте от 3 до 5 лет и 49 детей в возрасте от 6 до 9 лет получили две дозы другой вакцины с содержанием AS03 и 3,75 мкг HA штамма A/Vietnam/1194/2004 (H5N1) в 0 и 21 день.
Уровень серо-защиты, показатель сероконверсии и фактор сероконверсии для anti-HA у этих лиц был таким:
|
anti-HA антитіла anti-HA антитела |
A/Vietnam/1194/2004 A/Vietnam/1194/2004 | |||
|
Дети от 3 до 5 лет |
Дети от 6 до 9 лет | |||
|
21 день після |
21 день після после |
21 день после |
21 день после | |
|
Уровень серозащиты (*) 1 |
46,5% |
100% |
56,7% |
100% |
|
Уровень сероконверсии 2 |
46,5% |
100% |
56,7% |
100% |
|
Фактор сероконверсии 3 |
5,0 |
191,3 |
5,5 |
176,7 |
* Anti-HA ? 1:40
1 Уровень серозащиты: пропорция лиц с титром угнетения гемагглютинина (HI) ? 1:40;
2 Уровень сероконверсии: пропорция лиц, которые были серонегативными до и имеют защитный титр ? 1:40 после вакцинации, или же были серопозитивными до вакцинации и получили 4-кратный рост титра;
3 Фактор сероконверсии: соотношение средне-геометрического титра (GMT) после вакцинации и до нее.
4-кратный рост в сыворотке титра нейтрализующих антител наблюдался у 97,4% лиц в возрасте 3-5 лет и в 100% лиц в возрасте 6-9 лет через 21 день после введения 2-й дозы.
Также была оценена устойчивость иммуногенности у этих детей через 6 месяцев. Уровень серо-защиты, показатель сероконверсии и фактор сероконверсии для anti-HA на 180 день составлял соответственно 82,8%, 82,8% и 16 у детей 3-5 лет и 78%, 78% и 12,3 у детей 6-9 лет.
Информация из неклинических исследований
Способность вызывать защиту против гомологичных вакцинных штаммов была определена в неклинических условиях относительно A/Indonesia/05/05 (H5N1) с применением модели испытания на хорьках.
- Испытания с использованием гомологического пандемического H5N1 штамма (A/Indonesia/5/05)
В этом эксперименте относительно защитных свойств, хорьки (шесть групп) были внутримышечно иммунизированны исследуемыми версиями вакцин, содержащими три различные дозы антигена H5N1 (7,5, 3,8 и 1,9 мкг HA антигена) вместе со стандартной или половинной дозой адъюванта AS03. Контрольные группы включали в себя хорьков, иммунизированных одним лишь адъювантом и одной лишь вакциной без адъюванта (7,5 мкг HA). Хорьки, иммунизированные без-адъювантной вакциной против гриппа H5N1, оказались незащищенными и погибли, проявив подобную картину уменьшенной вирусной нагрузки в легких и частичное вирусное поражение верхних дыхательных путей, что было обнаружено и у животных, иммунизированных одним лишь адъювантом. С другой стороны, комбинации разных доз антигена H5N1 с адъювантом AS03 обнаружили способность защищать от смерти, уменьшать вирусную нагрузку в легких и влиять на распространение вируса после внутри-трахеального введения гомологического дикого типа вируса H5N1. Серологические исследования показали прямую корреляцию между торможением гемагглютинации под действием вакцин и нейтрализующими титрами антител в защищенных животных по сравнению с контрольными группами, которым был введен только антиген или адъювант.
Вакцины, используемые в фармакологических исследованиях
Pandemrix™ - вакцина H1N1 с адъювантом AS03, содержащиая 5,25 мкг или 3,75 мкг HA, полученного из A/California/7/2009 (H1N1), изготовленная в г. Дрезден, Германия, по другой технологии, чем Arepanrix™ H1N1 (A/California/7/2009).
Другая вакцина H5N1 с адъювантом AS03 содержит 3,75 мкг HA, полученного из A/Vietnam/1194/2004 (H5N1; ранее была известна под названием Pandemrix™ H5N1) также изготовлена в г. Дрезден, Германия, по той же технологии, что и Pandemrix™ (со штаммом H1N1).
Arepanrix™ H5N1 - вакцина H5N1 с адъювантом AS03, содержащая 3,75 мкг HA, полученного из A/Indonesia/5/2005 (H5N1), изготовленная в г. Квебек, Канада по той же технологии, что и пандемическая вакцина Arepanrix™ H1N1 (A / California).
Фармакокинетика
Оценка фармакокинетических свойств не является обязательной для вакцин.
Доклинические данные о безопасности
Неклинические данные не показали специфического негативнорго влияния на людей на основе традиционных исследований безопасности фарм. препаратов, токсичности одной и повторяемых доз, местной реакции, женской репродуктивности, токсичности для эмбриона/плода и постнатальной токсичности до завершения лактационного периода.
Два исследования в отношении репродуктивности проводились с антигеном H5N1 с адъювантом и оценили влияние на эмбрион/плод, перинатальное и постнатальное развитие у крыс после внутримышечного введения. Хотя и нельзя сделать никаких окончательных выводов относительно возможной связи с вакциной H5N1 и/или адъювантом AS03, и другие данные являются нормальными, следующие результаты заслуживают внимания: в первом исследовании наблюдалось увеличение случаев пороков эмбрионов с выразительным средним утолщением/изгибом ребер и деформацией лопаток, а также увеличение случаев расширение мочеточников и задержек невро-поведенческого развития. Во втором исследовании наблюдалось увеличение случаев выкидышей после имплантации плодного яйца, а также утолщение мочеточников у плода. В обоих исследованиях не были обработаны все данные, поэтому существенность токсикологического воздействия осталась неопределенной.
5.0 Фармацевтические особенности
Перечень вспомогательных веществ
Антиген, суспензия во флаконе: тимеросал, хлорид натрия, фосфат натрия водорода, фосфат калия дигидрофосфат, калия хлорид, вода для инъекций. Вещество препарата содержит остаточные следы яичного белка, формальдегида, дезоксихолата натрия и сахарозы.
Адъювант, эмульсия во флаконе: хлорид натрия, фосфат натрия водорода, фосфат калия дигидрофосфат, калия хлорид, вода для инъекций.
Несовместимость
В связи с отсутствием достаточных исследований этот препарат не следует использовать одновременно с другими лекарственными средствами.
Срок годности
Суспензия антигена является стабильной на протяжении 18 месяцев.
Эмульсия адъюванта стабильна 3 года.
После смешивания вакцину необходимо использовать в течение 24 часов. Рекомендуется сохранять смешанный препарат при температуре 2 ° - 8 °C, однако при необходимости можно сохранять его и при комнатной температуре. В случае охлаждения препарат нужно довести до комнатной температуры перед введением. Химическая и физическая стабильность для использования была продемонстрирована в течение 24 часов при температуре 30 °C.
Особые меры предосторожности для хранения
Хранить при температуре +2 °С до +8 °С (в холодильнике).
Не замораживать.
Хранить в оригинальной упаковке с целью защиты от света.
Характер и содержание контейнеров
Одна упаковка содержит:
- 1 упаковка из 50 флаконов (стекло, тип 1) по 2,5 мл суспензии (10 доз по 0,25 мл) с пробкой (бутилкаучук без латекса);
- 2 упаковки по 25 флаконов (стекло, тип 1) по 2,5 мл эмульсии (10 доз по 0,25 мл) с пробкой (бутилкаучук без латекса).
Объем, полученный после смешивания 1 флакона суспензии и 1 флакона эмульсии, позволяет ввести 10 доз по 0,5 мл вакцины (5 мл).
Инструкции по использованию / применению
Arepanrix™ H1N1 состоит из двух контейнеров: один мультидозовий флакон, содержащий антиген (суспензия) и второй мультидозовий флакон с адъювантом (эмульсия). Суспензия с антигеном имеет цвет от полупрозрачного до беловато-молочного и может содержать небольшой осадок. Эмульсия - беловатая однородная жидкость.
Для использования эти два компонента должны быть смешаны. Все содержимое адъювантной эмульсии нужно переместить во флакон с антигеном и перемешать.
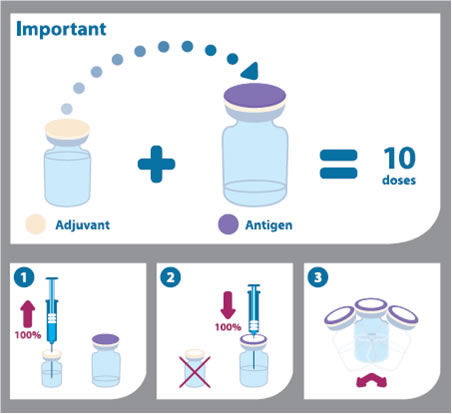
Инструкция по смешиванию и введению вакцины (как показано на пиктограмме ниже):
- Перед смешиванием двух компонентов флаконы должны быть доведены до комнатной температуры, а также нужно встряхнуть эмульсию и суспензию и визуально осмотреть на предмет наличия каких-либо недостатков.
- Вакцину смешивают путем извлечения всего содержимого флакона с эмульсией при помощи шприца и добавления его во флакон, содержащий суспензию антигена.
- После добавления эмульсии к суспензии, смесь нужно хорошо встряхнуть. Смешанная вакцина имеет вид беловатой эмульсии. В случае другого вида или изменений в смеси, она не должна использоваться.
- Этот смешанный объем Arepanrix™ H1N1 (5 мл) включает в себя 10 доз вакцины.
- Флакон должен встряхиваться перед каждым использованием.
- Каждая доза вакцины 0,5 мл набирается в шприц для инъекций. Перед использованием вакцина должна быть доведена до комнатной температуры.
- Игла, которая использовалась для набора дозы из флакона, должна быть заменена на иглу для внутримышечных инъекций.
Любой неиспользованный продукт или отходы должны удаляться в соответствии с местными требованиями.

Arepanrix™ H1N1 является торговой маркой группы компаний GlaxoSmithKline.
Информация для потребителя
Arepanrix™ H1N1
Вакцина против пандемического H1N1 гриппа с адъювантом AS03.
Этот текст является частью "Комплектации пакета" и предназначен специально для потребителей. Он представляет собой резюме и не содержит всех подробностей об Arepanrix™ H1N1. Обратитесь к своему врачу или фармацевту, если у вас есть какие-либо вопросы относительно вакцины.
Минздрав Канады разрешило продажу Arepanrix™ H1N1 на основе ограниченных клинических испытаний на людях в соответствии с положениями Временного Порядка, опубликованного 13 октября 2009. Разрешение базируется на изучении Министерством здравоохранения Канады имеющейся информации о качестве вакцины, ее безопасности и иммуногенности. Учитывая текущую угрозу пандемии и ее риск для здоровья людей, Минздрав Канады считает соотношение преимуществ и рисков от использования вакцины Arepanrix™ H1N1 приемлемым для активной иммунизации против штамма гриппа H1N1 2009 в условиях официально объявленной пандемической ситуации.
В рамках разрешения на продажу Arepanrix™ H1N1 Минздрав Канады требует от инициаторов постмаркетинговых обязательств. Выполнение этих обязательств и обновление информации о качестве, неклинических и клинических данных будет постоянно отслеживаться Министерством здравоохранения Канады и Агентством общественного здравоохранения Канады.
Об этой вакцине
Назначение вакцины: Arepanrix™ H1N1 является вакциной для защиты от гриппа, вызываемого вирусом H1N1.
Действие:
После введения вакцины в организм иммунная система (естественная система защиты организма) вырабатывает антитела против вируса H1N1. Ожидается, что эти антитела будут защищать от заболевания, вызванного вирусом. Ни один из ингридиентов вакцины не может вызывать грипп. Вакцина не содержит живого вируса.
Как и любая другая вакцина, Arepanrix™ H1N1 не может полностью защитить всех людей, которые были вакцинированы.
Когда она не должна использоваться:
Не используйте эту вакцину, если у вас уже наблюдались аллергические реакции с угрозой для жизни на:
- яичный белок (яйца или блюда из них) или куриный белок;
- другие вакцинации против гриппа;
- любой компонент этой вакцины.
Признаки аллергической реакции могут включать сыпь, зуд кожи, одышку, отек лица и языка.
Медицинские ингредиенты:
Антиген гриппа H1N1 из штамма A/California/7/2009 NYMC X-179A (H1N1) v и адъювант AS03
Важные немедицинские ингридиенты:
Тимеросал, производная ртути, добавляется в качестве консерванта. Каждая доза содержит 2,5 мкг ртути.
Другие ингредиенты включают: сквален, витамин Е, полисорбат 80, остаточные следы яичного белка, формальдегида, дезоксихолата натрия и сахарозы.
Полный перечень немедицинских ингредиентов см. в первой части документа (раздел 5.0).
Производится в форме:
Arepanrix™ H1N1 - это двух-компонентная вакцина, состоящая из суспензии антигена, которая имеет цвет от полупрозрачного до беловато-молочного и может образовывать легкий осадок, и беловатой эмульсии, содержащей адъювант AS03. Вакцина Arepanrix™ H1N1 - это эмульсия для инъекций.
Меры безопасности
Серьезные предупреждения и меры безопасности
Немедленно обратитесь к врачу или медсестре, если вскоре после введения возникли следующие реакции:
- сыпь на теле,
- скованность в горле,
- одышка.
ПРЕЖДЕ ЧЕМ использовать Arepanrix™ H1N1, сообщите Вашему врачу или медицинской сестре, если:
- у вас тяжелое инфекционное заболевание с высокой температурой,
- у вас ослабленая иммунная система из-за лечения или заболевания, например ВИЧ.
Взаимодействие с другими вакцинами
Пока отсутствует информация об использовании Arepanrix™ H1N1 совместно с другими вакцинами.
Надлежащее использование этой вакцины
Обычная доза:
Одна инъекция. Может быть введена вторая доза. Вторую дозу следует вводить с интервалом не менее 3 недель после первой.
- Дети (> 9 лет) и взрослые: 0,5 мл / доза
- Дети 3-9 лет: 0,25 мл / доза
- Дети 6-35 месяцев 0,25 мл / доза (Нет клинических данных о применении вакцин против гриппа с адъювантом AS03 для этой возрастной группы).
Информация об этом продукте будет регулярно обновляться. Следите за сайтом Министерства здравоохранения Канады для получения актуальной информации об этом продукте.
Побочные эффекты и реакция на них
Как и все лекарственные средства, Arepanrix™ H1N1 может вызвать побочные последствия. Самые распространенные и частые побочные реакции являются обычно несильными и должны продолжаться не более 1-2 дней.
Самые распространенные (могут возникать у более чем 1 / 10 вакцинированных):
- Боль в месте инъекции
- Головная боль
- Усталость
- Покраснение или отек в месте инъекции
- Озноб
- Потоотделение
- Боль в мышцах или в суставах
Частые (могут возникать у менее чем 1 из 10 вакцинированных):
- Реакции в месте инъекции, такие как гематомы, зуд и гарячисть
- Лихорадка
- Отек лимфатических узлов
- Тошнота, диарея
Редкие (могут возникать менее 1 из 100 доз):
- Головокружение
- Общее плохое самочувствие
- Необычная слабость
- Рвота, боль в желудке, дискомфорт в желудке, отрыжка после еды
- Нарушение сна
- Покалывание или онемение конечностей рук или ног
- Одышка
- Боль в груди
- Кожный зуд, сыпь
- Боль в спине или шее, скованность мышц, спазмы мышц, боли в конечностях рук или ног.
Одиночные (могут иметь место до 1 на 1000 доз):
- Аллергические реакции, которые могут вызвать серьезные повышение кровяного давления, которое, если не принять мер, может вызвать шок. Врачи знают о такой возможности и имеют средства для неотложной помощи в этом случае.
- Судороги.
- Сильная пронзительная или пульсирующая боль вдоль одного или нескольких нервов.
- Низкое количество тромбоцитов, что может приводить к кровотечению или гематомам.
Очень редкие (могут случаться до 1 на 10000 доз):
- Васкулит (воспаление кровеносных сосудов, которое может вызвать сыпь на коже, боль в суставах и проблемы с почками.
- Неврологические расстройства, такие как энцефаломиелит (воспаление центральной нервной системы), невриты (воспаление нервов) и тип паралича, известный как синдром Гийена-Барре.
При возникновении любой из этих реакций немедленно сообщите врачу или медсестре. Если любая из этих реакций получает серьезное течение, или возникла какая-то реакция, не входящая в приведенный список, пожалуйста, сообщите об этом врачу.
Хранение
Хранить в холодильнике (2 °С до +8 °С) в оригинальной упаковке для защиты от света. Не замораживать.
Хранить в недоступном для детей месте.
Сообщение о возникновении возможных побочных действий
Для мониторинга безопасности вакцины Агентство общественного здравоохранения Канады собирает информацию о серьезных и неожиданных побочных реакциях после вакцинации. Если Вы подозреваете, что у вас возникла серьезная или неожиданная реакция после вакцинации, сообщите в Агентство общественного здравоохранения Канады:
- По бесплатному телефону: 1-866-844-0018
- По бесплатному факсу: 1-866-844-5931
- По электронной почте: caefi@phac-aspc.gc.ca
- По почте:
Безопасность вакцин
Центр по иммунизации и респираторным инфекционным заболеваниям,
Агентство общественного здравоохранения Канады
130 Colonnade Road
Address Locator: 6502A
Ottawa, Ontario K1A 0K9
ПРИМЕЧАНИЕ: Если вам нужна информация, связанная с лечением возникших побочных эффектов, свяжитесь с вашим врачом перед тем как отправлять сообщение в Агентство общественного здравоохранения Канады. Агентство общественного здравоохранения Канады не дает медицинских рекомендаций.
Дополнительная информация
Этот документ вместе с полным вкладышем для пакета, подготовленный для медицинских работников, можно найти по адресу: http://www.gsk.ca или связавшись с автором:
GlaxoSmithKline Inc.
7333 Mississauga Road
Mississauga, Ontario L5N 6L4
1-800-387-7374
Эта информация подготовлена компанией GlaxoSmithKline Inc.
© 2009 GlaxoSmithKline Inc. Все права защищены ™AREPANRIX H1N1
Последняя редакция: 21 октября 2009
Первая версия перевода этой инструкции на украинском языке была размещена здесь: http://uka-didych.livejournal.com/254520.html
Мы очень признательны за тяжелый и кропотливый труд переводчика!
Перевод на русский язык © ОО "Лига защиты гражданских прав". 21 ноября 2009
Комментарий автора перевода:
16 ноября 2009 3:31
Я переводила сопроводительный листок к вакцине Arepanrix от свиного гриппа канадского производства, которую сейчас регистрируют в Украине. И которую рекомендуют применять в первую очередь для групп риска, среди которых дети и беременные женщины.
Мало того, все данные о безопасности и эффективности базируются на ограниченных клинических испытаниях других "подобных" вакцин с другим штаммом и/или иной технологией производства, а эта вакцина Arepanrix™ H1N1 прошла только, если не ошибаюсь, два небольших испытания (остальные прошли чуть больше)!
Более того, ни эта, ни другие "подобные" вакцины не имеют никаких данных относительно безопасности для беременных и плода, а подобные испытания проводились только на крысах!
Так еще и эти испытания на крысах показали угрозу для плода!!!
И тем не менее ее рекомендуют колоть беременным !!!!!
И это в условиях пандемии сытая Канада (заметьте, Канада, а не Гондурас!) позволяет эту вакцину использовать для своих граждан.
Ну пускай я - "маргиналка-сектантка"-антипрививочница, но среди моих френдов есть разумно-мыслящие люди, даже врачи.
Вот скажите, по вашему личному мнению, неужели этот грипп столь опасная болезнь, и эта пандемия настолько угрожающая, что этим можно оправдать такие вот беспрецедентные разрешения массово использовать абсолютно нетестированный препарат, сделанный "на коленке"? Я еще могу понять, если бы это была смертельно опасная болезнь ...
Пиарьте, распространяйте, читайте, думайте.
А меня, пока я это переводила, не покидала еще одна мысль.
В описании всех исследований фигурируют в основном 4 вакцины. Две канадские - одна технология, и две немецкие - другая технология. В каждой группе - два штамма: свиной и ... птичий.
Помнится мне, что до вакцинации от "птичьего" гриппа так и не дошло (или я ошибаюсь?), а деньги-то в разработку вбухали немалые. А пока шли клинические испытания, то да се, уже и паника тогда утихла. Судя по документу, обе "свиная" и "птичья" вакцины сделаны по той же самой технологии... Я не буду говорить, какие выводы я сделала. Делайте свои...
ОО "Лига защиты гражданских прав" разделяет вышеприведенные мысли и призывает всех неравнодушных граждан не поддаваться панике из-за "смертельной пандемии" H1N1 и очень взвешенно относиться к вопросу вакцинации против этого гриппа, как и к любой другой вакцинации!





Последние комментарии
21 неделя 6 дней назад
22 недели 3 дня назад
23 недели 1 день назад
44 недели 4 дня назад
5 лет 6 недель назад
5 лет 19 недель назад
5 лет 19 недель назад
6 лет 31 неделя назад
6 лет 37 недель назад
6 лет 51 неделя назад